L'entropie et le deuxième principe
Le deuxième principe de la thermodynamique stipule qu'au cours d'une transformation spontanée, l'entropie S de l'univers (système + milieu extérieur) ne peut que croître. Sa variation est nulle pour une transformation réversible et positive pour une transformation irréversible.
ΔSunivers = ΔSsystème + ΔSenvironnement ≥ 0
Au cours d'une réaction où les réactifs sont transformés en produits, la variation d'entropie de réaction se détermine de la manière suivante :
Le deuxième principe de la thermodynamique stipule qu'au cours d'une transformation spontanée, l'entropie S de l'univers (système + milieu extérieur) ne peut que croître. Sa variation est nulle pour une transformation réversible et positive pour une transformation irréversible.
ΔSunivers = ΔSsystème + ΔSenvironnement ≥ 0
Au cours d'une réaction où les réactifs sont transformés en produits, la variation d'entropie de réaction se détermine de la manière suivante :
Figure 29: Deuxième principe
où, S(produits) et S(réactifs) sont les entropies molaires des différentes substances mises en jeu. Leurs valeurs sont tabulées dans les tables thermodynamiques.
Pour les systèmes isolés, ΔSenvironnement = 0, et ΔSunivers = ΔSsystème. La variation d'entropie du système peut alors être :
soit positive si elle conduit à une augmentation du désordre, ΔS > 0 ;
soit négative si elle conduit à une augmentation de l'ordre, ΔS < 0.
L'enthalpie libre ΔG : un critère d'évolution du système
Très généralement, on a affaire à un système non isolé, et ΔSenvironnement ≠ 0.
Ce qui amène à introduire une nouvelle fonction thermodynamique : l'enthalpie libre G qui est un critère de spontanéité indépendant du milieu extérieur.
L’enthalpie libre de la réaction est la différence entre la somme des enthalpies libre de formation des produits et la somme des enthalpies libre de formation des réactifs. Les réactifs et les produits étant pris dans l’état standard ; c'est-à-dire à une pression de 1 bar et une température de 298 K.
Pour les systèmes isolés, ΔSenvironnement = 0, et ΔSunivers = ΔSsystème. La variation d'entropie du système peut alors être :
soit positive si elle conduit à une augmentation du désordre, ΔS > 0 ;
soit négative si elle conduit à une augmentation de l'ordre, ΔS < 0.
L'enthalpie libre ΔG : un critère d'évolution du système
Très généralement, on a affaire à un système non isolé, et ΔSenvironnement ≠ 0.
Ce qui amène à introduire une nouvelle fonction thermodynamique : l'enthalpie libre G qui est un critère de spontanéité indépendant du milieu extérieur.
L’enthalpie libre de la réaction est la différence entre la somme des enthalpies libre de formation des produits et la somme des enthalpies libre de formation des réactifs. Les réactifs et les produits étant pris dans l’état standard ; c'est-à-dire à une pression de 1 bar et une température de 298 K.
Pour un processus se déroulant à pression et température constantes, l’enthalpie libre est également égale :
ΔG = ΔH - TΔS
À nouveau, deux possibilités :
- ΔG < 0 : réaction spontanée dans les conditions standard;
- ΔG > 0 : réaction non spontanée dans les conditions standard.
Exemples :
• Combustion de l'acétylène
ΔG = ΔH - TΔS
À nouveau, deux possibilités :
- ΔG < 0 : réaction spontanée dans les conditions standard;
- ΔG > 0 : réaction non spontanée dans les conditions standard.
Exemples :
• Combustion de l'acétylène
ΔG = ΔG°CO2(g) + ΔG°H2O(l) - ΔG°C2H2(g) - ΔG°O2(g)
ΔG = - 394,35 – 237,15 + 209,20 + 0
ΔG = - 422,20 kJ pour une mole
ΔG < 0, il s’agit donc d’une réaction spontanée. En présence d’air et d’une énergie d’activation, l’acétylène s’enflamme spontanément.
« Un lundi matin, le salarié d’une entreprise de bâtiment s’approche de son véhicule de service. Dans sa camionnette se trouvent plusieurs bouteilles de gaz dont une d’acétylène. Il actionne sa télécommande pour ouvrir la portière. Une violente explosion se produit. Son véhicule est détruit. Par chance, il est seulement blessé. »
⇒ La cause : des fuites d’acétylène en présence d’oxygène de l’air + source d’énergie électrique
Source : association française des gaz comprimés
ΔG = - 394,35 – 237,15 + 209,20 + 0
ΔG = - 422,20 kJ pour une mole
ΔG < 0, il s’agit donc d’une réaction spontanée. En présence d’air et d’une énergie d’activation, l’acétylène s’enflamme spontanément.
« Un lundi matin, le salarié d’une entreprise de bâtiment s’approche de son véhicule de service. Dans sa camionnette se trouvent plusieurs bouteilles de gaz dont une d’acétylène. Il actionne sa télécommande pour ouvrir la portière. Une violente explosion se produit. Son véhicule est détruit. Par chance, il est seulement blessé. »
⇒ La cause : des fuites d’acétylène en présence d’oxygène de l’air + source d’énergie électrique
Source : association française des gaz comprimés
En savoir plus
Exemple : comparaison de ΔfH° et
Δ
fG°
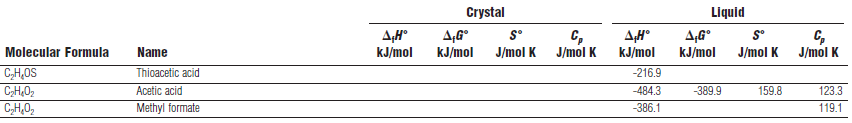
ΔfH° et ΔfG° < 0 ; La réaction de formation de l’acide acétique est une réaction spontanée et exothermique.