L'intérêt de l'enthalpie de formation (ΔfH°(T)) réside dans le fait qu'elle permet de calculer l'enthalpie standard de réaction (ΔrH°(T)) (Annexe :
Rappels de thermodynamique
)de n'importe quelle réaction. Celle-ci correspond à la différence des enthalpies de formation entre les produits de la réaction et les réactifs. Soit l'équation suivante :
Figure 24: Enthalpie standard de réaction
avec νi correspondant aux coefficients stœchiométriques.
Figure 25: Schéma de principe du calcul par différence de l'enthalpie de réaction (Source : Urs von Stockar, Wikimedia, domaine public)

On constate sur ce schéma qu'au cours d'une transformation, si le système consomme de la chaleur provenant du milieu extérieur, la réaction est dite endothermique et l’enthalpie de réaction est positive. Au contraire, si on assiste à une libération de chaleur vers le milieu extérieur au cours d’une transformation, la réaction est dite exothermique et l'enthalpie de réaction est négative.
L'application de ce principe aux réactions conduit à l'énoncé suivant, qui constitue la loi de Hess : « si une réaction peut être écrite sous la forme d'une combinaison linéaire de plusieurs équations-bilans de réactions, l'enthalpie standard de cette réaction à la température T, s'obtient à partir des enthalpies standards des différentes réactions à la même température par une combinaison linéaire faisant intervenir les mêmes coefficients. ».
ΔrH°(T) = ΣνiΔfH°(T)
L’enthalpie d’une réaction ΔrH°(T) est donc égale à la somme (Σ) des enthalpies de formation ΔfH°(T) de chacun des éléments présents dans la réaction, multipliées par les coefficients stœchiométriques íirespectifs à chacun de ces éléments. (íi étant négatif pour un réactif et positif pour un produit)
Autrement dit, l'enthalpie de réaction d'un système est indépendante du chemin suivi.
Deux exemples de calcul d’une enthalpie de réaction :
♦ Calcul de la variation d’enthalpie de la réaction de combustion de à 298,15 K :
Méthode 1 : Sans décomposition de la réaction
L'application de ce principe aux réactions conduit à l'énoncé suivant, qui constitue la loi de Hess : « si une réaction peut être écrite sous la forme d'une combinaison linéaire de plusieurs équations-bilans de réactions, l'enthalpie standard de cette réaction à la température T, s'obtient à partir des enthalpies standards des différentes réactions à la même température par une combinaison linéaire faisant intervenir les mêmes coefficients. ».
ΔrH°(T) = ΣνiΔfH°(T)
L’enthalpie d’une réaction ΔrH°(T) est donc égale à la somme (Σ) des enthalpies de formation ΔfH°(T) de chacun des éléments présents dans la réaction, multipliées par les coefficients stœchiométriques íirespectifs à chacun de ces éléments. (íi étant négatif pour un réactif et positif pour un produit)
Autrement dit, l'enthalpie de réaction d'un système est indépendante du chemin suivi.
Deux exemples de calcul d’une enthalpie de réaction :
♦ Calcul de la variation d’enthalpie de la réaction de combustion de à 298,15 K :
Méthode 1 : Sans décomposition de la réaction
ΔrH°1 = ΔfH°CO2(g) - ΔfH°C(s) - ΔfH°O2(g)
Les ΔfH° des molécules prenant part à cette réaction sont données dans les Tableaux 5 et 7.
ΔrH° = -393, 51 - 0,00 - 0,00
ΔrH° = -393, 51 kJ
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
Les ΔfH° des molécules prenant part à cette réaction sont données dans les Tableaux 5 et 7.
ΔrH° = -393, 51 - 0,00 - 0,00
ΔrH° = -393, 51 kJ
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
Activité
Expliquez le sens de ce résultat.
Cette réaction peut également être découpée en deux étapes :
Méthode 2 : Décomposition de la réaction en 2 étapes
Méthode 2 : Décomposition de la réaction en 2 étapes
Figure 27: Décomposition de la réaction en 2 étapes
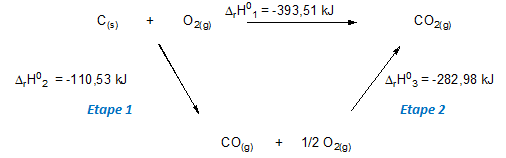
Comme l'enthalpie standard de réaction d'un système est indépendant du chemin suivi (application de la loi de Hess), l'enthalpie ΔrH°1 correspond à :
ΔrH°1 = ΔrH°2 + ΔrH°3
En proportion stœchiométrique, le carbone réagit premièrement avec la moitié de l’oxygène présent pour former le monoxyde de carbone (étape 1). Ce composé formé réagit ensuite avec l’oxygène restant pour former le dioxyde de carbone CO2 (étape 2).
ΔrH° de la réaction globale de combustion du carbone est donc la somme de ΔrH°2de formation du CO et ΔrH°3de formation du CO2.
ΔrH1= -110,52 - 282,98 = 393,5kj pour une mole
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
ΔrH°1 = ΔrH°2 + ΔrH°3
En proportion stœchiométrique, le carbone réagit premièrement avec la moitié de l’oxygène présent pour former le monoxyde de carbone (étape 1). Ce composé formé réagit ensuite avec l’oxygène restant pour former le dioxyde de carbone CO2 (étape 2).
ΔrH° de la réaction globale de combustion du carbone est donc la somme de ΔrH°2de formation du CO et ΔrH°3de formation du CO2.
ΔrH1= -110,52 - 282,98 = 393,5kj pour une mole
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
Activité
Expliquez ce schéma.
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est à dire qu'elle est exothermique.
2) Calcul de la variation d’enthalpie de la réaction de combustion de l’acide éthanoïque à 298,15 K :
2) Calcul de la variation d’enthalpie de la réaction de combustion de l’acide éthanoïque à 298,15 K :
Figure 28: Réaction de combustion de l'acide éthanoïque
ΔrH° = 2 ΔfH°CO2 (g) + 2 ΔfH°H2O (l) - ΔfH°CH3COOH (l) – 2 ΔfH°O2 (g)
ΔrH° = 2 x (-393,51) + 2 x (-285,83) – 1 x (-484,30) – 2 x 0,00
ΔrH° = - 874,38 kJ [1].
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
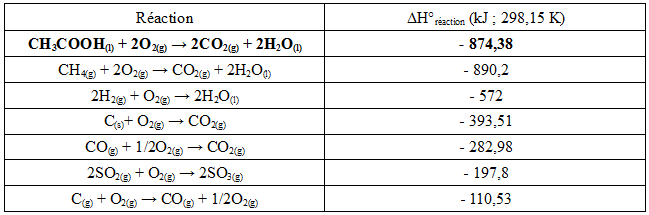
Il est possible de comparer l'enthalpie standard de réaction de la combustion de l'acide acétique avec les valeurs de ΔrH°(T) issues d'autres réactions de combustion (Tableau 5).
ΔrH° = 2 x (-393,51) + 2 x (-285,83) – 1 x (-484,30) – 2 x 0,00
ΔrH° = - 874,38 kJ [1].
La valeur négative de ΔrH°, nous apprend que la réaction libère de l'énergie sous forme de chaleur, c'est-à-dire qu'elle elle est exothermique.
Il est possible de comparer l'enthalpie standard de réaction de la combustion de l'acide acétique avec les valeurs de ΔrH°(T) issues d'autres réactions de combustion (Tableau 5).
Tableau 5: Variations d'enthalpie de quelques réactions
• Exemple de réaction endothermique :
Réaction de dissociation de l'ammoniac
2NH3(g) → N2(g) + 3H2(g)
ΔrH° = ( 3ΔfH°H2 (g) + ΔfH°N2 (g) ) - 2 ΔfH°NH3 (g)
ΔrH° = 0 + 0 + (2 x 46,11)
ΔrH° = 92,22 kJ pour une mole
La réaction de dissociation de l’ammoniac a une valeur d’enthalpie standard de réaction positive. La réaction consomme de l'énergie. Elle est dite endothermique.
Réaction de dissociation de l'ammoniac
2NH3(g) → N2(g) + 3H2(g)
ΔrH° = ( 3ΔfH°H2 (g) + ΔfH°N2 (g) ) - 2 ΔfH°NH3 (g)
ΔrH° = 0 + 0 + (2 x 46,11)
ΔrH° = 92,22 kJ pour une mole
La réaction de dissociation de l’ammoniac a une valeur d’enthalpie standard de réaction positive. La réaction consomme de l'énergie. Elle est dite endothermique.
Des caractéristiques chimiques des produits : peuvent conduire à des réactions exothermiques, parfois incontrôlées provoquant :
- Une déflagration,
- Une inflammation,
- La projection de matières dangereuses,
- L’émission de gaz toxiques.
Des tables donnent les enthalpies standards de formation de diverses substances afin de pouvoir effectuer les calculs. Pour dresser des tables d'enthalpies molaires standards il a été choisi de définir l'échelle d'enthalpie de la manière suivante: l'enthalpie molaire standard d'un corps pur simple stable dans l'état standard est nulle à 298 K.Dans le tableau qui suit, on peut voir les valeurs de quelques enthalpies de formation à 298 K (25°C) :
- Une déflagration,
- Une inflammation,
- La projection de matières dangereuses,
- L’émission de gaz toxiques.
Des tables donnent les enthalpies standards de formation de diverses substances afin de pouvoir effectuer les calculs. Pour dresser des tables d'enthalpies molaires standards il a été choisi de définir l'échelle d'enthalpie de la manière suivante: l'enthalpie molaire standard d'un corps pur simple stable dans l'état standard est nulle à 298 K.Dans le tableau qui suit, on peut voir les valeurs de quelques enthalpies de formation à 298 K (25°C) :
Tableau 6: Exemples d’enthalpie standard de formation à 25 °C. Source : (Lide DR, 2004)
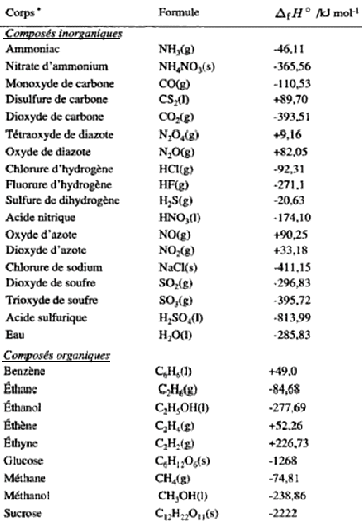
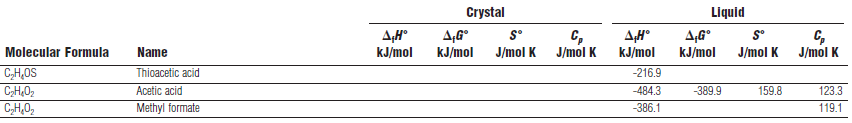
Tableau 7: D'autres exemples d'enthalpies standard de formation à 25°C. Source : (Lide DR, 2004)
La connaissance de la valeur d’enthalpie H permet d’évaluer la chaleur mise en jeu au cours de la réaction (en fonction de la composition du mélange). Cette fonction présente donc un fort intérêt dans le cas de situations à risque.
Il est donc possible dans le cas de composés endothermiques d’estimer le caractère exothermique de leurs décompositions.
Exemple :
Il est donc possible dans le cas de composés endothermiques d’estimer le caractère exothermique de leurs décompositions.
Exemple :
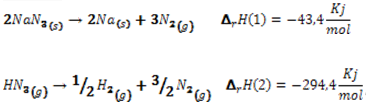
Ces deux composés sont instables et leurs réactions de décomposition est exothermiques. En valeur algébrique, ΔrH (1) <ΔrH (2) donc en cas d’explosion ou d’incendie la réaction de décomposition de HN3(g) sera plus violente que celle de NaN3(s).
Cette évaluation a été approfondie par la méthode d’estimation CHETAH (ChemicalThermodynamic and EnergyHazardevaluation) mis au point par American Society for testing and material (ASTM).
Le risque potentiel est décomposé en 3 niveaux caractérisés par des critères. Le risque est d’autant plus élévé si le critère C1 est plus négatif que le critère C2.
Avec
Cette évaluation a été approfondie par la méthode d’estimation CHETAH (ChemicalThermodynamic and EnergyHazardevaluation) mis au point par American Society for testing and material (ASTM).
Le risque potentiel est décomposé en 3 niveaux caractérisés par des critères. Le risque est d’autant plus élévé si le critère C1 est plus négatif que le critère C2.
Avec
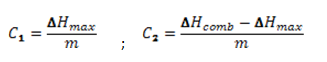
Ce calcul est aussi bien applicable à l’explosivité qu’à l’inflammabilité (l’inflammation en phase gaz étant un type d’explosion).
Sources : Prédiction des limites inférieures d’explosivité dans l’air. Application des critères termochimiques pour les gaz et vapeurs de substances.
D. Dalmazzone, ENSTA. INRS – Paris
Sources : Prédiction des limites inférieures d’explosivité dans l’air. Application des critères termochimiques pour les gaz et vapeurs de substances.
D. Dalmazzone, ENSTA. INRS – Paris