Source principale : (Guyot, 2010 )
)
Dans une polymérisation en chaîne, une chaîne macromoléculaire est formée par additions successives de molécules de monomère M à une espèce active qui est porté par l’extrémité de la chaîne pour former un polymère.
La « chaîne cinétique » commence par l’élaboration du centre actif qui constitue le site d’amorçage, capable d’attaquer une première molécule de monomère. L’ensemble de ces deux événements constitue la réaction d’amorçage proprement dite. La molécule formée reste porteuse d’un centre actif de même nature et est donc capable d’attaquer une nouvelle molécule de monomère, et ainsi de suite. La chaîne cinétique se poursuit donc par un grand nombre de réactions de cette nature, dites réactions de propagation. Elle se termine par la destruction du centre actif, dite réaction d’arrêt ou de terminaison. La chaîne cinétique peut aussi être coupée par quelques réactions de transfert, où l’extrémité active se transfère de la chaîne macromoléculaire en croissance à une autre molécule, dite agent de transfert, qui devient à son tour active.
Selon le signe de la charge portée par la chaine croissante, on distingue :
- Les polymérisations cationiques dans lesquelles A-est le contre-ion négatif associé au cation porté par la chaîne en croissance. Les monomères utilisés sont riches en électrons.
–M+ n , A- + M → –M+ n+1 , A-
Exemple de la polymérisation du polyisobutène : étape de propagation
 )
)Dans une polymérisation en chaîne, une chaîne macromoléculaire est formée par additions successives de molécules de monomère M à une espèce active qui est porté par l’extrémité de la chaîne pour former un polymère.
La « chaîne cinétique » commence par l’élaboration du centre actif qui constitue le site d’amorçage, capable d’attaquer une première molécule de monomère. L’ensemble de ces deux événements constitue la réaction d’amorçage proprement dite. La molécule formée reste porteuse d’un centre actif de même nature et est donc capable d’attaquer une nouvelle molécule de monomère, et ainsi de suite. La chaîne cinétique se poursuit donc par un grand nombre de réactions de cette nature, dites réactions de propagation. Elle se termine par la destruction du centre actif, dite réaction d’arrêt ou de terminaison. La chaîne cinétique peut aussi être coupée par quelques réactions de transfert, où l’extrémité active se transfère de la chaîne macromoléculaire en croissance à une autre molécule, dite agent de transfert, qui devient à son tour active.
Selon le signe de la charge portée par la chaine croissante, on distingue :
- Les polymérisations cationiques dans lesquelles A-est le contre-ion négatif associé au cation porté par la chaîne en croissance. Les monomères utilisés sont riches en électrons.
–M+ n , A- + M → –M+ n+1 , A-
Exemple de la polymérisation du polyisobutène : étape de propagation
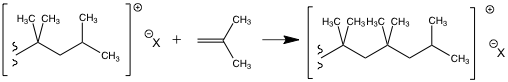
Plus de détails sur ce type de réaction dans l'annexe (  Annexe polymérisation
).
Annexe polymérisation
).
- Les polymerisations anioniques dans lesquelles Met+, en général un cation métallique, est le contre-ion positif associé à la chaine anionique.
–M- n , Met+ + M → –M- n+1 , Met+
 Annexe polymérisation
).
Annexe polymérisation
).- Les polymerisations anioniques dans lesquelles Met+, en général un cation métallique, est le contre-ion positif associé à la chaine anionique.
–M- n , Met+ + M → –M- n+1 , Met+
Plus de détails sur la réaction en annexe
- Les polymérisations radicalaires dans lesquelles le centre actif est constitué par un groupe moléculaire porteur d’un électron non apparié, entité de grande réactivité dont l’espèce originelle est généralement obtenue par rupture homolytique d’une liaison covalente au sein des molécules d’amorceur, en présence du monomère :
-Mn • + M " -Mn+1 •
- Les polymérisations radicalaires dans lesquelles le centre actif est constitué par un groupe moléculaire porteur d’un électron non apparié, entité de grande réactivité dont l’espèce originelle est généralement obtenue par rupture homolytique d’une liaison covalente au sein des molécules d’amorceur, en présence du monomère :
-Mn • + M " -Mn+1 •
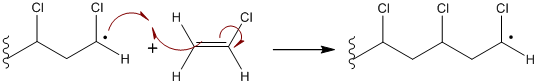
Ces radicaux libres donnent lieu à diverses réactions que nous retrouvons au cours de différentes étapes de la polymérisation en chaine : addition, élimination, combinaison, transfert.
Plus de détails sur la réaction en annexe.
Dangers associés aux polymérisations :
La réaction de polymérisation, souvent exothermique, peut s’emballer et donc représenter un risque d’autant plus important que le monomère est inflammable.
C’est en particulier le cas du méthacrylate de méthyle (utilisée en laboratoire d’histologie pour
l’inclusion des prélèvements osseux) qui peut se polymériser « spontanément » avec explosion :
Plus de détails sur la réaction en annexe.
Dangers associés aux polymérisations :
La réaction de polymérisation, souvent exothermique, peut s’emballer et donc représenter un risque d’autant plus important que le monomère est inflammable.
C’est en particulier le cas du méthacrylate de méthyle (utilisée en laboratoire d’histologie pour
l’inclusion des prélèvements osseux) qui peut se polymériser « spontanément » avec explosion :
Figure 58: Polymérisation du méthacrylate de méthyle
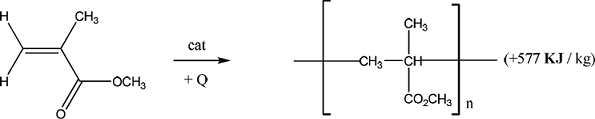
Les réactions de polymérisation (radicalaires ou ioniques) sont amorcées par des composés instables comme les peroxydes, les acides forts (BF3) ou des organométalliques (BuLi) qui réagissent violemment avec l'eau par exemple. Des précautions particulières sont à prendre concernant leur stockage et leur utilisation.
Les polymères crées peuvent relarguer des monomères ou des molécules auxiliaires utilisées pour modifier les propriétés techniques des polymères (stabilisants, plastifiants). Certains plastifiants sont des perturbateurs endocriniens comme les phtalates. Certains monomères sont suspectés ou reconnus cancérigènes comme le chlorure de vinyle du PVC, le styrène du polystyrène...
Les polymères crées peuvent relarguer des monomères ou des molécules auxiliaires utilisées pour modifier les propriétés techniques des polymères (stabilisants, plastifiants). Certains plastifiants sont des perturbateurs endocriniens comme les phtalates. Certains monomères sont suspectés ou reconnus cancérigènes comme le chlorure de vinyle du PVC, le styrène du polystyrène...