Masse volumique d’une substance (symbole ρ)
Masse d'une substance par unité de volume à une température donnée. Surtout, à ne pas confondre avec la densité (cf. définition suivante).
Masse d'une substance par unité de volume à une température donnée. Surtout, à ne pas confondre avec la densité (cf. définition suivante).
Figure 12: Masse volumique d'une substance
Ce concept de masse volumique permet de comparer les masses de volumes identiques de substances. On se sert, à cet effet, d’un pycnomètre.
La masse volumique d’une substance dépend de la température puisque le volume d’une masse donnée de n’importe quelle substance varie avec la température. Pour la plupart des substances, la masse volumique diminue lorsque la température augmente vu que le volume de la plupart de celles-ci augmente proportionnellement à l’augmentation de leur température.
La masse volumique, de même que la température, sont des exemples de propriétés intensives d’une substance, c’est-à-dire de propriétés dont les valeurs sont indépendantes de la quantité de ladite substance.
Densité d'un liquide (symbole dliquide)
Nombre sans unité, exprimant le rapport de la masse d’un certain volume d’un corps à celle du même volume d’eau.
La masse volumique d’une substance dépend de la température puisque le volume d’une masse donnée de n’importe quelle substance varie avec la température. Pour la plupart des substances, la masse volumique diminue lorsque la température augmente vu que le volume de la plupart de celles-ci augmente proportionnellement à l’augmentation de leur température.
La masse volumique, de même que la température, sont des exemples de propriétés intensives d’une substance, c’est-à-dire de propriétés dont les valeurs sont indépendantes de la quantité de ladite substance.
Densité d'un liquide (symbole dliquide)
Nombre sans unité, exprimant le rapport de la masse d’un certain volume d’un corps à celle du même volume d’eau.
Figure 13: Densité d'un liquide
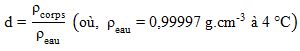
Masse volumique d'un gaz (symbole ρgaz)
Le comportement physique des gaz obéit à des lois simples tant que l'on on peut leur appliquer :
l’approximation des gaz parfaits (basse pression),
C’est-à-dire un modèle théorique idéal qui suppose notamment que les molécules sont sans interaction les unes avec les autres et qu’elles n’ont pas de volume propre.
La loi ou l'équation des gaz parfaits répond à la relation suivante :
PV = nRT
La constante de proportionnalité R est la constante des gaz parfaits. En unités SI, on exprime P (pression du gaz) en Pascal (Pa), V (volume occupé par le gaz) en mètre-cube (m3), n (nombre de moles du gaz) en mole (mol), T (température du gaz) en Kelvin (K) [T(K) = T(°C) + 273,15]. Et alors la constante R = 8,314 J mol-1.K-1.
L’équation des gaz parfaits peut être mise à profit pour calculer les masses volumiques des gaz, comme suit :
Le comportement physique des gaz obéit à des lois simples tant que l'on on peut leur appliquer :
l’approximation des gaz parfaits (basse pression),
C’est-à-dire un modèle théorique idéal qui suppose notamment que les molécules sont sans interaction les unes avec les autres et qu’elles n’ont pas de volume propre.
La loi ou l'équation des gaz parfaits répond à la relation suivante :
PV = nRT
La constante de proportionnalité R est la constante des gaz parfaits. En unités SI, on exprime P (pression du gaz) en Pascal (Pa), V (volume occupé par le gaz) en mètre-cube (m3), n (nombre de moles du gaz) en mole (mol), T (température du gaz) en Kelvin (K) [T(K) = T(°C) + 273,15]. Et alors la constante R = 8,314 J mol-1.K-1.
L’équation des gaz parfaits peut être mise à profit pour calculer les masses volumiques des gaz, comme suit :
Figure 14: Equation des gaz parfaits
On observera que la masse volumique d’un gaz augmente lorsque sa pression augmente et lorsque sa température diminue.
Densité d'un gaz (symbole dgaz)
On calcule la densité des gaz à partir de la densité de l'air. La valeur de référence prise est la masse d'un litre d'air à 0 °C sous une pression de 760 mm Hg, soit 1,29349 g. On a ainsi :
Densité d'un gaz (symbole dgaz)
On calcule la densité des gaz à partir de la densité de l'air. La valeur de référence prise est la masse d'un litre d'air à 0 °C sous une pression de 760 mm Hg, soit 1,29349 g. On a ainsi :
Figure 15: Densité d'un gaz
Il existe une façon commode de relier la masse molaire, notée M, d'un gaz et sa densité, repérée par dgaz. En effet, en considérant la loi des gaz parfaits, PV = nRT, d'où :
Figure 16: Développement 1
On a donc :
Figure 17: Développement 2
Et,
Figure 19: Densité du gaz 2
En tenant compte seulement des trois principaux gaz composant l'air et de leur masse molaire respective (environ 78 % de diazote N2, 21 % d'oxygène O2 et 1 % d'argon Ar), il est facile de montrer que :
Mair ≈ (0,78 x 2 x 14,01) + (0,21 x 2 x 15,90) + (0,01 x 39,95) ≈ 28,93 g.mol-1
Soit,
Mgaz ≈ 28,93 Mair
Il existe une autre manière d'arriver à ce résultat. En effet, dans les conditions normales de température et de pression (CNTP), c'est-à-dire T = 0°C (273,15 K) et P = 1atm (P = 1,013.105 Pa), 1 mole de gaz (quel que soit le gaz) occupe un volume molaire Vm = 22,41 L.mol-1. D'où, 22,41 x 1,29 (correspondant à la masse de gaz pour 1L) = 28,98 g.mol-1.
Par exemple, la densité du méthane est :
Mair ≈ (0,78 x 2 x 14,01) + (0,21 x 2 x 15,90) + (0,01 x 39,95) ≈ 28,93 g.mol-1
Soit,
Mgaz ≈ 28,93 Mair
Il existe une autre manière d'arriver à ce résultat. En effet, dans les conditions normales de température et de pression (CNTP), c'est-à-dire T = 0°C (273,15 K) et P = 1atm (P = 1,013.105 Pa), 1 mole de gaz (quel que soit le gaz) occupe un volume molaire Vm = 22,41 L.mol-1. D'où, 22,41 x 1,29 (correspondant à la masse de gaz pour 1L) = 28,98 g.mol-1.
Par exemple, la densité du méthane est :
Figure 19: Densité du méthane
Il découle logiquement de cette relation que plus un gaz possède une masse molaire élevée, plus il est dense.
Tableau de quelques densités de gaz
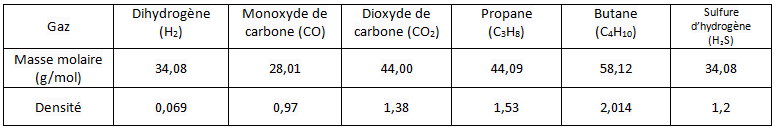
On remarque que le monoxyde de carbone, qui est extrêmement toxique, incolore et inodore, présente une densité très proche de celle de l’air. Il se diffusera donc facilement dans l’air ambiant.
Le propane et le butane sont des gaz à utilisation domestique. Ils possèdent des densités supérieures à l’air et se diffuseront donc vers le bas. Ils sont donc dangereux dans les milieux clos et mal ventilés.
Le propane et le butane sont des gaz à utilisation domestique. Ils possèdent des densités supérieures à l’air et se diffuseront donc vers le bas. Ils sont donc dangereux dans les milieux clos et mal ventilés.