Quelques exemples de gaz cryogénisés et leurs températures caractéristiques sont rappelées dans le tableau 3.
Tableau 24: gaz cryogénisés et températures caractéristiques.

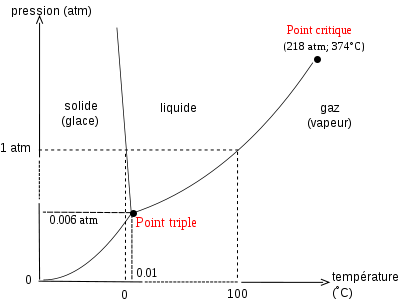
Le point triple correspond à la condition (valeur de température et de pression) sous laquelle une substance peut être à la fois gazeuse, liquide ou solide.
Le point critique correspond à la condition expérimentale (valeur de température et de pression) à partir de laquelle une substance ne peut plus passer de l’état liquide à l’état gazeux.
Exemple : diagramme de phase de l’eau :
Le point critique correspond à la condition expérimentale (valeur de température et de pression) à partir de laquelle une substance ne peut plus passer de l’état liquide à l’état gazeux.
Exemple : diagramme de phase de l’eau :
Crédits
Source de l’image : Jacques Janin (
http://fr.academic.ru
)
Pour tous les gaz cryogénisés :
Un gaz cryogénisé étant maintenu à très basse température puisqu'inférieure à la température d’ébullition de cette molécule, il peut provoquer :
- des brûlures (yeux, peau),
- la fragilisation des aciers,
- le durcissement des plastiques.
Un gaz cryogénisé étant maintenu à très basse température puisqu'inférieure à la température d’ébullition de cette molécule, il peut provoquer :
- des brûlures (yeux, peau),
- la fragilisation des aciers,
- le durcissement des plastiques.
Figure 55: Pictogramme du froid (Source: INRS)

Exemple
Vidéo : Explosion bouteille d'azote liquide
http://www.youtube.com/watch?v=qTkuvgpUv5M
Cas spécifiques :
- Lorsque le gaz à une température d'ébullition inférieure à celle du dioxygène il peut y avoir un risque d'anoxie par condensation de l'oxygène de l'air, ce qui diminue la quantité d'oxygène sous forme gazeuse et donc disponible pour la respiration.
- Le dioxygène liquide étant très oxydant, il est capable d’enflammer toute matière organique. Ce même risque existe avec l’air liquide qui ne contient que 21 % d'O2.
- Lorsque le gaz à une température d'ébullition inférieure à celle du dioxygène il peut y avoir un risque d'anoxie par condensation de l'oxygène de l'air, ce qui diminue la quantité d'oxygène sous forme gazeuse et donc disponible pour la respiration.
- Le dioxygène liquide étant très oxydant, il est capable d’enflammer toute matière organique. Ce même risque existe avec l’air liquide qui ne contient que 21 % d'O2.