Pression de vapeur (symbole Pv) ou tension de vapeur
C’est la pression qu’exercent, à une température donnée, les vapeurs d’un liquide d’un récipient clos qui le contient. Pv indique la rapidité avec laquelle les vapeurs diffusent dans l'atmosphère. Plus Pv est importante, plus le liquide s'évapore facilement et davantage il peut se diffuser dans l'atmosphère. Pv a la particularité d'augmenter rapidement avec la température.
C’est la pression qu’exercent, à une température donnée, les vapeurs d’un liquide d’un récipient clos qui le contient. Pv indique la rapidité avec laquelle les vapeurs diffusent dans l'atmosphère. Plus Pv est importante, plus le liquide s'évapore facilement et davantage il peut se diffuser dans l'atmosphère. Pv a la particularité d'augmenter rapidement avec la température.
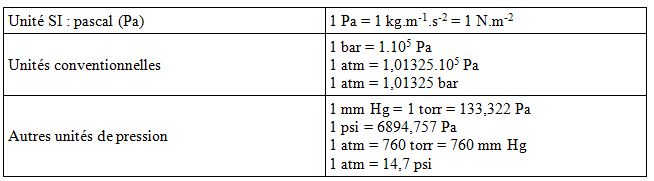
Tableau 3: Les unités de pression
Point d'ébullition (symbole Téb)
Considérons un liquide dans un récipient ouvert à l'air libre, en équilibre avec sa vapeur saturante de pression notée po. Lorsqu'il est chauffé, sa température (T) et sa pression de vapeur, (po) augmentent jusqu'à ce que cette dernière soit égale à la pression imposée, désignée par pimp, qui, dans ce cas, est la pression atmosphérique. Si le chauffage est maintenu, la pression de vapeur saturante se stabilise à la valeur imposée, pimp, et, par conséquent, la température reste constante à la valeur Téb tant que les phases liquide et vapeur sont en présence ; la chaleur fournie au liquide est uniquement utilisée pour sa vaporisation.
Cette dernière se fait par la surface libre mais aussi, essentiellement, au sein du liquide, par émission de bulles de vapeur qui viennent bouillonner à la surface ; c'est le phénomène d'ébullition. La température ébullition constante, Téb, à laquelle il a lieu est appelé point d'ébullition sous la pression pimp . Pour que ce mécanisme de vaporisation interne puisse se produire normalement, il est nécessaire que des micro-volumes d'air existent au sein du liquide.
Considérons un liquide dans un récipient ouvert à l'air libre, en équilibre avec sa vapeur saturante de pression notée po. Lorsqu'il est chauffé, sa température (T) et sa pression de vapeur, (po) augmentent jusqu'à ce que cette dernière soit égale à la pression imposée, désignée par pimp, qui, dans ce cas, est la pression atmosphérique. Si le chauffage est maintenu, la pression de vapeur saturante se stabilise à la valeur imposée, pimp, et, par conséquent, la température reste constante à la valeur Téb tant que les phases liquide et vapeur sont en présence ; la chaleur fournie au liquide est uniquement utilisée pour sa vaporisation.
Cette dernière se fait par la surface libre mais aussi, essentiellement, au sein du liquide, par émission de bulles de vapeur qui viennent bouillonner à la surface ; c'est le phénomène d'ébullition. La température ébullition constante, Téb, à laquelle il a lieu est appelé point d'ébullition sous la pression pimp . Pour que ce mécanisme de vaporisation interne puisse se produire normalement, il est nécessaire que des micro-volumes d'air existent au sein du liquide.
Figure 20: Ébullition d'un liquide à l'air libre
