Du fait de leur mise en forme, de leur réactivité chimique, de leurs propriétés redox ou de leurs propriétés thermodynamiques, certaines substances peuvent générer des accidents et des dommages sur l’homme et l’environnement.
L’identification et la classification des produits chimiques et polluants requièrent la connaissance de leurs caractéristiques physico-chimiques qui reposent sur un certains nombres de paramètres dont nous allons revoir les principes généraux.
Sources principales : (Angenault, 1995 ) et (McQuarrie, McQuarrie, & Rock, 1992
) et (McQuarrie, McQuarrie, & Rock, 1992 )
)
Sources principales : (Angenault, 1995
 ) et (McQuarrie, McQuarrie, & Rock, 1992
) et (McQuarrie, McQuarrie, & Rock, 1992 )
)
Masse molaire d'un composé (symbole M)
Nombre de grammes que représente une mole de ce composé. kg.mol-1 (usuellement g.mol-1).
Nombre de grammes que représente une mole de ce composé. kg.mol-1 (usuellement g.mol-1).
Figure 11: Définition de la masse molaire
Exemple
Exemples : pour l'ion calcium (II) : M (Ca2+) = 40,08 g.mol-1 pour la molécule d'éthanol : M (CH3CH2OH) = 2 x MC + 6 x MH + MO = 2 x 12,01 + 6 x 1,01 + 15,99 = 46,07 g.mol-1
Solubilité
Pour ce qui concerne les espèces ioniques, leur comportement en solution s'évalue au moyen de leur produit de solubilité Ks.
À une température donnée, le produit de solubilité (symbole Ks) est une constante relative à la solubilité dans un solvant (en général l'eau) d'un solide ionique peu soluble. Les concentrations sont assimilées aux activités, la formation de paires d'ions étant négligée. Ainsi, pour un solide ionique AnBp peu soluble, l'équilibre entre le solide et ses produits de dissociation s'écrit :
AnBp(s) ↔ nAp- (aq) + pBn+ (aq)
avec n et p = coefficients stœchiométriques ; s = de forme solide ; aq = aqueux, c'est à dire dissout dans l'eau.
Le produit de solubilité est le produit des concentrations des deux ions dans l’eau, dont les coefficients stoechiométriques deviennent exposants.
Pour ce qui concerne les espèces ioniques, leur comportement en solution s'évalue au moyen de leur produit de solubilité Ks.
À une température donnée, le produit de solubilité (symbole Ks) est une constante relative à la solubilité dans un solvant (en général l'eau) d'un solide ionique peu soluble. Les concentrations sont assimilées aux activités, la formation de paires d'ions étant négligée. Ainsi, pour un solide ionique AnBp peu soluble, l'équilibre entre le solide et ses produits de dissociation s'écrit :
AnBp(s) ↔ nAp- (aq) + pBn+ (aq)
avec n et p = coefficients stœchiométriques ; s = de forme solide ; aq = aqueux, c'est à dire dissout dans l'eau.
Le produit de solubilité est le produit des concentrations des deux ions dans l’eau, dont les coefficients stoechiométriques deviennent exposants.
Exemple
Exemple. sulfate d'aluminium Al2(SO4)3(s) ↔ 2Al3+ (aq) + 3SO4 2- (aq)
Le produit de solubilité Ks est Ks (T) = [Ap- (aq)]n [Bn+ (aq)]p .
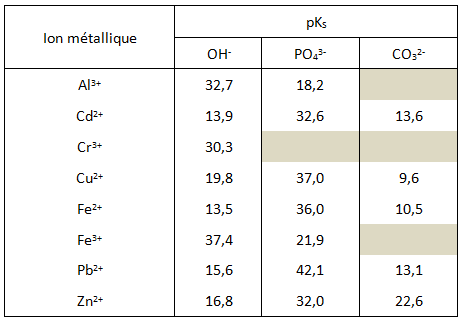
Une autre façon d’exprimer la solubilité d’un solide est le pKS, qui est l’inverse du logarithme du KS. L’échelle logarithmique est plus pratique à utiliser au vu des valeurs atteintes (parfois très élevées). Plus le pKs est élevé, plus le composé est soluble.
pKS= -log(KS)
La solubilité varie avec la nature du contre-ion, le pH et la température.
Une autre façon d’exprimer la solubilité d’un solide est le pKS, qui est l’inverse du logarithme du KS. L’échelle logarithmique est plus pratique à utiliser au vu des valeurs atteintes (parfois très élevées). Plus le pKs est élevé, plus le composé est soluble.
pKS= -log(KS)
La solubilité varie avec la nature du contre-ion, le pH et la température.
Tableau 2: Produit de solubilité de quelques ions métalliques associés à différents contre-ions. Source : (Bliefert, 2001)