Source principale : (Lemarquand & Triolet, 2002 )
)
La stabilité d'une molécule est déterminée par des facteurs structuraux internes et externes. Certaines de ces caractéristiques favorisent la stabilité d'une molécule alors que d'autres la déstabilisent.
Le principal facteur stabilisant d'une molécule est la longueur de chaine. Plus la chaine carbonée d'une molécule est longue, plus le composé sera stable. Par exemple le nitrométhane (CH3-NO2) (carburant de véhicules de course) est moins stable que le nitroéthane (CH3-CH2-NO2) qui est lui-même moins stable que le nitrobutane (CH3-CH2-CH2-CH2-NO2), etc...
Les facteurs structuraux internes qui peuvent intervenir dans l'instabilité d'une molécule sont nombreux.
- Les liaisons inter-atomes de faible énergie (par exemple O-O ou N-N) sont prépondérantes puisqu'elles sont le(s) point(s) fragile(s) de la molécule.
- Le caractère endothermique, dû aux liaisons multiples (doubles ou triples), va créer un danger par l'exothermicité de la réaction de décomposition.
- Le caractère "redox interne" agit lorsque dans une molécule, deux fonctions incompatibles interagissent l'une sur l'autre pour fragiliser l'ensemble du composé.
- Il faut aussi noter les contraintes physiques sur un composé lorsqu'un cycle comprenant peu d'atomes (moins de 5) va forcer les angles de liaisons à s'éloigner de l'optimal.
- Une répétition de fonction (même relativement stable comme NO2) va également diminuer la stabilité du composé.
- Les contres ions sont aussi des éléments qui jouent sur l'énergie nécessaire à la décomposition des molécules chargées. Par exemple, l'azoture de sodium (Na+N3 -) est stable, mais l'azoture de plomb (Pb2+(N3 -)2) est un explosif primaire.
Les groupements présentant ces conditions sont dits explosophores.
Voir Annexe : Facteurs d'instabilité interne d'une molécule .
Des facteurs externes peuvent stabiliser une molécule, c'est le cas de la dilution qui joue le rôle de volant thermique, ou la déstabiliser, c'est le cas de la quantité qui empêche la dissipation de chaleur au cœur du produit et du confinement qui peut provoquer un régime détonant.
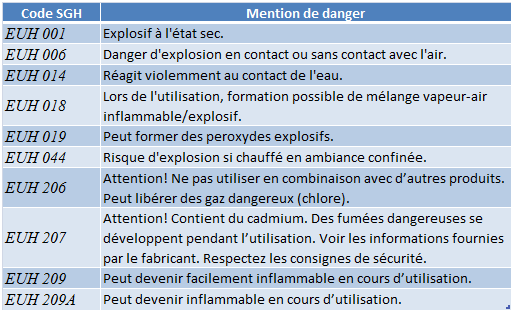
La réglementation 1272/2008 dite CLP classe les dangers relatifs aux substances instables à l'aide de phrases de danger EUH. Ces phrases sont reportées dans le tableau ci-après.
 )
)La stabilité d'une molécule est déterminée par des facteurs structuraux internes et externes. Certaines de ces caractéristiques favorisent la stabilité d'une molécule alors que d'autres la déstabilisent.
Le principal facteur stabilisant d'une molécule est la longueur de chaine. Plus la chaine carbonée d'une molécule est longue, plus le composé sera stable. Par exemple le nitrométhane (CH3-NO2) (carburant de véhicules de course) est moins stable que le nitroéthane (CH3-CH2-NO2) qui est lui-même moins stable que le nitrobutane (CH3-CH2-CH2-CH2-NO2), etc...
Les facteurs structuraux internes qui peuvent intervenir dans l'instabilité d'une molécule sont nombreux.
- Les liaisons inter-atomes de faible énergie (par exemple O-O ou N-N) sont prépondérantes puisqu'elles sont le(s) point(s) fragile(s) de la molécule.
- Le caractère endothermique, dû aux liaisons multiples (doubles ou triples), va créer un danger par l'exothermicité de la réaction de décomposition.
- Le caractère "redox interne" agit lorsque dans une molécule, deux fonctions incompatibles interagissent l'une sur l'autre pour fragiliser l'ensemble du composé.
- Il faut aussi noter les contraintes physiques sur un composé lorsqu'un cycle comprenant peu d'atomes (moins de 5) va forcer les angles de liaisons à s'éloigner de l'optimal.
- Une répétition de fonction (même relativement stable comme NO2) va également diminuer la stabilité du composé.
- Les contres ions sont aussi des éléments qui jouent sur l'énergie nécessaire à la décomposition des molécules chargées. Par exemple, l'azoture de sodium (Na+N3 -) est stable, mais l'azoture de plomb (Pb2+(N3 -)2) est un explosif primaire.
Les groupements présentant ces conditions sont dits explosophores.
Voir Annexe : Facteurs d'instabilité interne d'une molécule .
Des facteurs externes peuvent stabiliser une molécule, c'est le cas de la dilution qui joue le rôle de volant thermique, ou la déstabiliser, c'est le cas de la quantité qui empêche la dissipation de chaleur au cœur du produit et du confinement qui peut provoquer un régime détonant.
La réglementation 1272/2008 dite CLP classe les dangers relatifs aux substances instables à l'aide de phrases de danger EUH. Ces phrases sont reportées dans le tableau ci-après.
Tableau 25: Mentions de dangers de la réglementation CLP
Du fait de ces caractéristiques physico-chimiques, certains composés ne sont pas stables dans le temps. Ils peuvent donc se décomposer et perdre leurs propriétés, mais ils peuvent également se transformer en produits toxiques ou dangereux. Il arrive que certains vieux mélanges soient dangereux par exemple :
- un flacon 2-butanol a explosé au bout de 12 ans de stockage.
- L’acétylène (gaz incolore, à peine plus léger que l’air, inodore à l’état pur) est un composé très instable qui peut se décomposer en carbone et hydrogène ou se polymériser sous l’effet d’une pression ou d’une température. Il peut y avoir réaction explosive avec inflammation.
- A partir d’une semaine, certains éthers contiennent des quantités dangereuses de peroxydes. A six mois, c'est la plupart des éthers qui peuvent poser problème.
En effet, les composés tels que les éthers, les oléfines, les organométalliques… peuvent générer des peroxydes en présence d’oxygène. Ces peroxydes sont des composés chimiques oxydants et comburants, souvent instables et dangereux. Ils peuvent s’accumuler et être à l’origine de violentes explosions suite à une contrainte mécanique ou thermique. Il est donc important de connaître les composés peroxydables pour éviter les accidents de ce type.
Les composés communs donnant lieu à la formation de peroxydes au cours du stockage ont été classés en 3 listes selon leur dangerosité :
- La liste A contient des composés dont les dérivés peroxydés peuvent provoquer une explosion, même sans concentration du milieu.
- La liste B contient des composés dont les dérivés peroxydés peuvent provoquer une explosion que s’ils sont concentrés.
- La liste C contient des monomères dont les dérivés péroxydés peuvent amorcer une polymérisation explosive des monomères. Ceux-ci sont souvent stabilisés par un antioxydant : phénols, amines, …
- un flacon 2-butanol a explosé au bout de 12 ans de stockage.
- L’acétylène (gaz incolore, à peine plus léger que l’air, inodore à l’état pur) est un composé très instable qui peut se décomposer en carbone et hydrogène ou se polymériser sous l’effet d’une pression ou d’une température. Il peut y avoir réaction explosive avec inflammation.
- A partir d’une semaine, certains éthers contiennent des quantités dangereuses de peroxydes. A six mois, c'est la plupart des éthers qui peuvent poser problème.
En effet, les composés tels que les éthers, les oléfines, les organométalliques… peuvent générer des peroxydes en présence d’oxygène. Ces peroxydes sont des composés chimiques oxydants et comburants, souvent instables et dangereux. Ils peuvent s’accumuler et être à l’origine de violentes explosions suite à une contrainte mécanique ou thermique. Il est donc important de connaître les composés peroxydables pour éviter les accidents de ce type.
Les composés communs donnant lieu à la formation de peroxydes au cours du stockage ont été classés en 3 listes selon leur dangerosité :
- La liste A contient des composés dont les dérivés peroxydés peuvent provoquer une explosion, même sans concentration du milieu.
- La liste B contient des composés dont les dérivés peroxydés peuvent provoquer une explosion que s’ils sont concentrés.
- La liste C contient des monomères dont les dérivés péroxydés peuvent amorcer une polymérisation explosive des monomères. Ceux-ci sont souvent stabilisés par un antioxydant : phénols, amines, …
Figure 56: Composés Peroxydables au cours du stockage et étiquettes associées

En plus de l’étiquette réglementaire, il est préférable d’apposer une étiquette indiquant la date de réception et d’ouverture. Dans le cas des composés de la liste A, l’étiquette est rouge et indique que le composé devra au-delà de trois mois :
- Soit être éliminé selon la procédure indiquée sur la Fiche de Donnée de Sécurité.
- Soit être analysé par les tests à l’iodure ou au thiocyanate ferreux pour déterminer la quantité de peroxyde.
Les composés des listes B et C sont indiqués par une étiquette jaune et devront être analysés ou détruit au-delà de 12 mois.
L'annexe de formation des peroxydes ( Annexe formation du peroxyde
) donne plus de détails sur les mécanismes aboutissant à la création de ces composés dangereux.
Annexe formation du peroxyde
) donne plus de détails sur les mécanismes aboutissant à la création de ces composés dangereux.
- Soit être éliminé selon la procédure indiquée sur la Fiche de Donnée de Sécurité.
- Soit être analysé par les tests à l’iodure ou au thiocyanate ferreux pour déterminer la quantité de peroxyde.
Les composés des listes B et C sont indiqués par une étiquette jaune et devront être analysés ou détruit au-delà de 12 mois.
L'annexe de formation des peroxydes (
 Annexe formation du peroxyde
) donne plus de détails sur les mécanismes aboutissant à la création de ces composés dangereux.
Annexe formation du peroxyde
) donne plus de détails sur les mécanismes aboutissant à la création de ces composés dangereux.