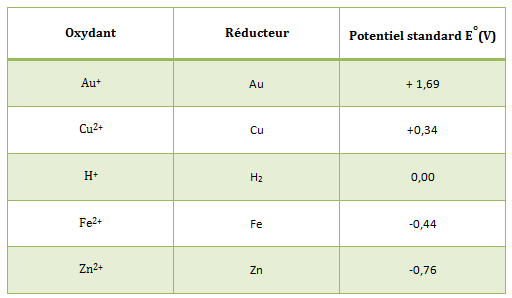
Potentiel standard
Le potentiel standard d'un couple redox est noté E° (Ox/Red) et exprimé en Volts (V). Il est obtenu entre l’électrode standard à H2 (E° (H+/H2) = 0 V) et le couple redox étudié.
Le potentiel standard d'un couple redox est noté E° (Ox/Red) et exprimé en Volts (V). Il est obtenu entre l’électrode standard à H2 (E° (H+/H2) = 0 V) et le couple redox étudié.
La connaissance des potentiels standards permet de situer les couples étudiés sur une échelle des couples redox. Ainsi, les oxydants forts auront des potentiels élevés positifs et les réducteurs forts des potentiels bas (négatifs). Cependant, la prévision du sens d'une réaction d'oxydo-réduction doit se faire sur la comparaison des E (potentiel d'un couple redox) (
Annexe Potentiel et pouvoir oxydant
) et non des E°.
Potentiel d'un couple redox et équation de Nernst :
Le potentiel d'un couple redox peut être calculé via l'équation de Nernst.
Pour la demi-équation suivante : αOx + n e- = βRed
L'équation de Nernst s'écrit :
E (Ox/Red) = E°(Ox/Red) + (RT/nF) ln(a(Ox) α/ a(Red))β (si stœchiométrie Ox et Red, alors α= β=1)
= E°(Ox/Red) + (RT/nF) ln([Ox]/[Red])
= E°(Ox/Red) + (0,06/n) Log([Ox]/[Red]) avec ln(10.RT/F) = 2,303 x 8,314 x (298,1 / 96485) = 0.06
Potentiel d'un couple redox et équation de Nernst :
Le potentiel d'un couple redox peut être calculé via l'équation de Nernst.
Pour la demi-équation suivante : αOx + n e- = βRed
L'équation de Nernst s'écrit :
E (Ox/Red) = E°(Ox/Red) + (RT/nF) ln(a(Ox) α/ a(Red))β (si stœchiométrie Ox et Red, alors α= β=1)
= E°(Ox/Red) + (RT/nF) ln([Ox]/[Red])
= E°(Ox/Red) + (0,06/n) Log([Ox]/[Red]) avec ln(10.RT/F) = 2,303 x 8,314 x (298,1 / 96485) = 0.06