6.1. Cas des polluants inorganiques
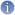 Informations[1]
Informations[1]Le rôle du pH
La variation de pH (naturelle ou anthropique) semble être le facteur dont l'action sur la mobilité des éléments traces métalliques est la plus déterminante. L'abaissement du pH favorise la mobilité des ETM, notamment par mise en solution de sels métalliques ou, lorsque le pH est très acide, la destruction de la phase de rétention.
Inversement, l'augmentation du pH provoque l'immobilisation par formation de composés insolubles (précipitation) ou accroissement de la capacité d'échange cationique. On notera cependant que certains ETM comme le bore, obéissent moins strictement à ce type de comportement ou, au contraire, dans le cas du molybdène, de l'arsenic et du sélénium présentent un comportement opposé : leur mobilité augmente avec le pH.
Actuellement, la mobilité des ETM n'est « contrôlée » que par le pH. C'est pourquoi, dans l'arrêté du 08/01/1998 (article 11 du Journal officiel, 1998), renforçant la norme AFNOR NF U44-041 (1985), le Ministère fixe la limite inférieure d'autorisation d'épandage de boues de stations d'épuration à pH 6 ; en deçà de cette valeur, l'épandage n'est autorisé que pour un apport de boues chaulées sur un sol de pH supérieur à 5, et dans la limite de flux maximum de boues sur 10 ans (tableau 12).
Cependant, McLaughlin et coll. (1994)[2] et Li et coll. (1995)[3] soulignent que la salinité d'un sol peut modifier l'effet du pH sur la mobilité des ETM. Ces auteurs ont constaté une augmentation de la mobilité du Cd avec une concentration en chlorure de l'ordre de 290 mg de Cl/kg de sol.
Le rôle du potentiel d'oxydoréduction
Le potentiel d'oxydoréduction du milieu joue un rôle important, d'abord en influençant directement l'état d'oxydation des ETM et donc leur mobilité, mais aussi en intervenant sur les composants du sol qui fixent les ETM. Il dépend du degré d'aération du sol, des pratiques culturales et des conditions climatiques. En conditions anoxiques, les composés ferriques et manganiques sont plus solubles et libèrent les éléments traces métalliques qui leurs sont associés. En revanche en conditions aérobies, les oxydes de Fe et Mn étant peu solubles, ils immobilisent les ETM (Deneux-Mustin et al., 2003). Ainsi, des conditions d'aération limitantes (conditions réductrices, potentiel rédox bas), résultant par exemple du compactage, de la battance du sol, ou de l'engorgement de la porosité du sol, facilitent la mobilité des ETM par solubilisation partielle des oxydes et transformation anaérobie des compartiments organiques du sol (les composés du fer et du manganèse, par exemple, sont réduits et solubilisés, libérant les ETM qui leur étaient associés). A l'inverse, dans des conditions d'un sol aéré (potentiel rédox haut), ces composés deviennent très peu solubles et immobilisent donc les ETM associés. Le potentiel redox est également influencé par l'utilisation d'accepteurs d'électrons disponibles dans le sol (N, Mn, Fe, S, C) par la microflore indigène (Francis, 1990).
Le rôle de la capacité d'échange cationique
La capacité d'échange cationique varie selon le type de sol, notamment selon la richesse en argile et en matière organique. En effet, les particules fines d'argile, à forte CEC, sont chargées négativement et adsorbent donc les particules de charges opposées. Elle caractérise la capacité d'un sol à stocker et à restituer les éléments minéraux : les particules fines d'argile, à forte CEC, sont chargées négativement et adsorbent donc les particules de charges opposées (Bourrelier et Berthelin, 1998). De ce fait, les cations métalliques peuvent se fixer à la surface des particules d'argile par échange de protons H+, entraînant une baisse de leur disponibilité.
Par sa CEC élevée, la matière organique influence également la mobilisation du cadmium par la plante ( Wermeille, 1998[4]), mais sa minéralisation peut le remettre en solution ce qui nécessite un apport régulier de matière organique. Il ne s'agit donc là que d'une immobilisation temporaire, dont le niveau est proportionnel à la quantité de matière organique apportée.
Plusieurs travaux ont également montré une réduction de l'absorption du Cd par la plante grâce à la complexation du métal par les matières organiques ( Somers, 1978[5] ; White et Chaney, 1980[6] ; Cabrera et coll., 1988[7]). Cependant selon Quilbé (2002),[8] la stabilité entre ETM et matière organique varie selon les éléments, les plus stables étant le plomb et le cuivre, puis le nickel et le cobalt. Le cadmium et le manganèse ont en revanche peu d'affinité pour la matière organique.
Le rôle de la texture et la structure du sol
La texture et la structure du sol sont des facteurs intervenant dans la mobilité des ETM. Dans un sol structuré, la vitesse de l'eau et des composés solubles est plus grande que dans une matrice constituée de micropores (Jury et al., 1991). Le transport par les colloïdes du sol (particules d'argile, matière organique soluble, biomasse) peut augmenter la mobilité des métaux associés à ces solides (Mills et al., 1991). Les pratiques culturales peuvent influencer la mobilité des métaux en modifiant les propriétés du sol et les conditions physico-chimiques, à la suite par exemple de l'apport de matière organique (boues chaulées ou non, composts, déjections animales, déchets divers) (Lavado et al., 2001). La nature et le mode d'application des fertilisants, la rotation des cultures et le labour jouent aussi un rôle important. L'oxygène étant l'anion structural dominant, aussi bien dans l'eau que dans les constituants solides du sol, la spéciation des ETM est dominée par leur interaction avec l'oxygène des molécules d'eau, des anions hydroxyde OH- ou oxyde O2-. Ainsi, plus un sol est aéré, moins le Cd est biodisponible. Or, le travail du sol entraîne alors une meilleure aération du sol ; inversement, le passage répété d'engins agricoles qui tassent le sol la réduit. Le degré d'aération du sol est aussi déterminé par les pratiques culturales (irrigation, apport de matière organique biodégradable donc consommatrice d'oxygène mais qui peut aussi améliorer l'aération du sol grâce à une meilleure structuration) et par les évènements climatiques (précipitations massives entraînant une réduction de l'aération du sol).
Le rôle des ligands complexants
Certains ligands complexants tels que NO2- et NH4+ facilitent la solubilisation des éléments traces métalliques ( Quilbé, 2002[8]). Ces ligands peuvent en effet modifier la sphère de coordination du cation métallique, et ainsi provoquer une modification profonde de la réactivité de ce dernier. Ce phénomène est accentué en conditions réductrices (Bourellier et Berthelin, 1998).
Le rôle de la température et l'humidité
La température et l'humidité jouent un rôle indirect sur l'assimilation des ETM par les végétaux supérieurs.
Une température élevée agit directement sur la dissolution des composés fixant les ETM, ce qui conduit généralement à une absorption plus importante de l'ETM par la plante ( Haghiri, 1974[9] ; Giordano et coll., 1979[10] ; Juste et Solda, 1984[11]). La température agit également sur l'activité biologique du sol, et donc sur la production de substances acides ou complexantes issues de la biodégradation des matières organiques.
L'humidité agit directement sur les processus de précipitation et de solubilisation. Un excès d'humidité conduit notamment à un potentiel rédox bas et donc à un défaut d'aération du sol ; l'humidité a donc une influence directe sur le potentiel d'oxydoréduction, dont les conséquences ont été précisées plus haut. L'humidité agit également sur l'activité biologique.
Le rôle de la biomasse microbienne
Bien que la biomasse microbienne n'excède pas quelques tonnes/ha, elle joue un rôle prépondérant dans la fixation des ETM (Ledin et coll., 1999) en comparaison de la matière organique non vivante et minérale du sol. La faune du sol contribue aussi, à un niveau moindre, à la fixation des ETM. Les micro-organismes interviennent directement ou indirectement dans la transformation des minéraux (dissolution, altération, dépôt, néoformation) (Bourrelier et Berthelin, 1998) et modifient le statut de divers éléments présents tant dans la phase solide que dans la solution des systèmes sol-plante (soluble-insoluble, oxydé-réduit...).
Mobilité des ETM et risques de contamination de la chaîne alimentaire
Selon les conditions du milieu et leurs propres propriétés, les ETM peuvent éventuellement s'associer avec les composés du sol, ce qui réduit ou accroît leur mobilité. Plus la mobilité de l'élément est élevée, plus la migration de ce dernier vers la solution du sol sera facilitée et plus le risque de contamination[12] de la chaîne alimentaire sera important.
Les plantes sont plus ou moins sensibles aux ETM. Elles réagissent de façon différente selon les variétés. Certaines sont peu ou pas tolérantes et meurent au contact des ETM. D'autres ont des réactions de défense, et freinent l'absorption en sécrétant des acides qui vont augmenter le pH et par conséquent réduire la mobilité des éléments traces. D'autres enfin, comme les céréales, le chou-fleur, les graminées fourragères, ou le concombre sont tolérantes aux ETM, et même les accumulent, puis les concentrent. Ces plantes sont dites « hyperaccumulatrices » et métallophytes.
L'accumulation des ETM dans les différentes parties végétatives de la plante varie selon le végétal. En général, les éléments traces sont absorbés par les racines, et y demeurent le plus souvent. Le passage dans les parties aériennes (tiges, feuilles) varie selon les ETM ; alors que le plomb s'accumule uniquement dans les racines, le cadmium se concentre davantage dans les feuilles et les tiges. Par ailleurs, les concentrations en ETM sont plus fortes dans les jeunes pousses (ADEME, 2003).
Pour une même espèce végétale, les concentrations en ETM qui passent dans la plante varient selon le type de sol. En effet, des études ont montré que pour une même variété de blé, les concentrations en cadmium varient dans la plante de 1 à 4,5 mg/kg selon les sols (Site Internet, 2003).
Une variabilité inter-annuelle de la contamination des plantes, conséquence d'années climatiques différentes (répercussion sur les conditions physico-chimiques du sol et donc sur la solubilité des ETM) peut également être constatée. Suite à la contamination unique du sol d'un dispositif agronomique alsacien par des ETM, Bourrié et coll. (1998)[13] ont montré que l'accumulation des ETM par du maïs, en particulier le cadmium, variait selon l'année. Il semble que la succession (intra et/ou inter annuelle) d'épisodes climatiques variés en soit l'explication.




